峰形差
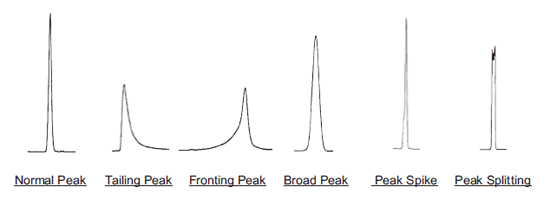
T1. 峰形差
| 症状 | 原因 | 解决方案 | |
|---|---|---|---|
| 只有特定样品拖尾 | 碱性化合物和填料之间发生了离子交换相互作用。 | 使用含有较少硅醇基的色谱柱(C18-MSII)。或在流动相中加入0.1-1%的酸。 | |
| 金属配位化合物和填料之间发生了络合反应。 | 在流动相中加入5mmol/l乙二胺四乙酸二水合物(EDTA・2Na)。 | ||
| 在样品和填料之间发生了氢键相互作用。 | 改变有机溶剂 (如乙腈变为甲醇)。 | ||
| 所有样品均拖尾 | 填料中产生了空隙或色谱柱劣化。 | 更换色谱柱。 | |
| (如果在更换色谱柱后拖尾情况没有改善) 样品在色谱柱外发生了扩散。 | 减少死体积 (请参考Q25)。 | ||
| 前沿峰 | 注入了大量洗脱性或pH值与流动相有较大差异的样本溶剂。 | 用流动相溶解样品。如果样品不能溶解于流动相,请先溶解到可用溶剂中然后用流动相稀释。 | |
| 减少进样量至1/2-1/10 注意; 可能会引起尖峰或宽锋。 |
|||
| 宽峰 1 高分子量样品 (MW: 2,000以上) |
大分子量蛋白质不能通过填料孔径。 | 使用反相宽孔径色谱柱,COSMOSIL Protein-R。 | |
| 进样量太大。 | 减少进样量至1/2-1/10 注意; 可能产生拖尾峰。 |
||
| 如果只有某种特定的样品产生宽峰,可能是由于有机化合物吸着在填充剂上。 | 推荐使用拥有高回收率的COSMOSIL Protein-R。 | ||
| 所有样品均严重拖尾,可能是色谱柱劣化。 | 更换色谱柱。 | ||
| 使用疏水色谱法色谱柱(HIC)时,样品溶液中的硫酸铵浓度太低。 | 调整硫酸铵的浓度至1 mol/l 或更多。 | ||
| 宽峰 2 低分子量样品 (MW: 2,000以下) |
进样量太大。 | 减少进样量至1/2-1/10 注意; 可能会引起拖尾峰。 |
|
| 如果只有某种特定的样品产生宽峰,可能是由于有机化合物吸着在填充剂上。 | 请使用不同填料的色谱柱。 (COSMOSIL 5C18-MS-II 适用于碱性样品。它对于碱性样品很少有吸收。) |
||
| 所有样品均出现宽峰,可能是色谱柱劣化。 | 更换色谱柱。 | ||
| 某些特定的峰出现尖峰或峰裂 | 含有两种以上的样品并且它们没有完全分离。 | 寻找可以分离这两种样品的条件。 | |
| 流动相和样品溶剂的溶解性差异太大。 | 用流动相溶解样品。如果样品不能溶解于流动相中,请先溶解到可用溶剂中然后用流动相稀释。 | ||
| 减少进样量至1/2到1/10。 | |||
| 解离样品和非解离样品混合 | 调节流动相的pH值至离子样本的pKa±2以上。 | ||
| 所有样品的峰都出现尖峰或峰裂 | 流动相和样品溶剂的溶解性差异太大。 | 用流动相溶解样品。如果样品不能溶解于流动相中,请先溶解到可用溶剂中然后用流动相稀释。 | |
| 减少进样量至1/2 到1/10。 | |||
| 色谱柱劣化。 | 更换色谱柱。 | ||
T2. 鬼峰
| 分离方式 | 原因 | 解决方案 | |
|---|---|---|---|
| <反相色谱法> 梯度洗脱法 |
鬼峰由水中杂质引起。 | 使用新的高效液相色谱级蒸馏水。 | |
| 使用预柱。 | |||
| <反相色谱法> 蛋白质样品的分析 |
色谱柱上吸附有前一次分析的样品,鬼峰由此样品引起 | 冲洗色谱柱。 | |
| 推荐使用不易吸附样品的COSMOSIL Protein-R | |||
| <所有分离方式> 样品溶剂和流动相不同。 |
鬼峰由样品溶剂引起。 | 使用与流动相一样的溶剂溶解样品。 | |
| 用流动相溶解样品。如果样品不能溶解于流动相中,请先溶解到可用溶剂中然后用流动相稀释。 | |||
| <所有分离方式> 无样品载入,只注入流动相时出现鬼峰 (同时每次分析时,峰面积都有减少) |
进样器污染。 | 用注射器注入20毫升可祛除污染物的溶剂(如甲醇)清洗进样器 | |
| 微量进样针污染。 | 用可祛除污染物的溶剂(如甲醇,氯仿或水)清洗进样针。推荐使用超声波清洗。 | ||
| 其他 | 样品受到污染或劣化。 | 重新配置样品。 | |
| 流动相中有稳定剂。 | 使用不含稳定剂的高效液相色谱级溶剂。 | ||