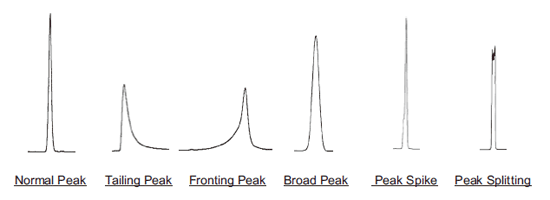
피크 모양 불량
T1. 피크 모양 불량
| 증상 | 원인 | 해답 | |
|---|---|---|---|
| 시료 중 일부 요소가 테일링 | 충진물과 염기성 화합물 사이에 이온 교환 작용발생. | 잔류 실라놀 그룹이 적은 C18-MS-II 칼람으로교체 또는 이동상에 0.1-1%사이의 산을 첨가. | |
| 금속배위 화합물과 충진물 사이의 배위작용. | 용매에 5mmol/l의 di-sodium dihydrogen ethylenediaminetetraacetatedihydrate (EDTA・2Na)을 첨가한다. | ||
| U충진물과 시료 사이의 수소결합 반응. | 유기용매 종류를 바꾼다(예: 아세토나이트릴에서 메탄올로). | ||
| 모든 종류의 시료가 테일링 (피크의 뒤 쪽 끌림)발생 |
충진물 내부에 공간이 생겼거나 칼람의 성능이악화됨. | 칼람 교환. | |
| (만약 칼람으로 교체 후에도 테일링이 개선이안되면) 시료가 칼람 출구에서 확산되어 나오는것임. | 불용체적(dead volume) 감소 (172 페이지 Q25의 불용체적에 관한 정보 참조). | ||
| 피크의 앞쪽 끌림(Fronting) | 많은 양의 시료를 주입 시 시료의 용출 특성이달라지거나 또는 용매의 pH 조절 불량. | 시용 용매로 시료를 녹인다. 만약 시료가 녹지않으면 먼저 잘 녹는 용매로 녹인 후 사용 용매에 다시 녹인다. | |
| 시료 주입량을 1/2-1/10사이로 줄임. 주의; 스파이크 피크가 발생하거나 피크가 넓어 질수 있다. |
|||
| 확산 피크(broad peak) 1시료의 분자량이 높을 때 (MW: 2,000 또는 이상) |
단백질과 같은 고분자는 충진물의 충진 입자 내부로 통과 할 수 없다. | 역상용 COSMOSIL Protein-R과 같은 내공이 큰충진 입자 칼람 사용(내공 크기: 300Å) 42 페이지에 자세한 정보가 있습니다. | |
| 시료 양이 너무 큼. | 시료 량을 1/2~1/10 사이로 줄인다. 주의; 테일링 피크가 발생 할 수 있습니다. |
||
| 시료 중 일부분의 피크가 확산되어 나올 경우,그 확산 피크의 화합물이 칼람 충진물에 흡착되기 때문입니다. | COSMOSIL Protein-R을 사용하십시오. 이 칼람은 회복율(recovery rate)이 매우 높습니다. 42페이지의 정보를 참고하십시오. | ||
| 모든 시료가 확산 피크로 나올 경우 칼람이 손상됐을 수 있습니다. | 칼람 교체. | ||
| 친 유성 크로마토그라피(HIC)일 경우 시료용매에 암모늄 설페이트(ammonium sulfate)농도가너무 낮음. | 암모늄 설페이트 농도를 1mol/l 또는 이상조정. | ||
| 확산 피크 2 시료 분자량이 낮을 때 (MW: 2,000 또는 이하) |
시료 량이 너무 클 때. | 시료 량을 1/2~ 1/10 사이로 줄임. 주의; 확산 피크 대신 테일링 피크가 발생 할 수 있습니다. |
|
| 시료 중 일부분의 피크가 확산되어 나올 경우, 그 확산 피크의 화합물이 칼람 충진물에흡착되기 때문입니다. | 충진물이 다른 칼람으로 교체하십시오. (염기성시료용으로 COSMOSIL 5C18-MS-II 칼람을 추천합니다).이 칼람은 염기성 화합물 흡착이 매우 낮습니다. 14 페이지를 참조하십시오. | ||
| 모든 시료가 확산 피크로 나올 경우 칼람이손상됐을 수 있습니다. | 칼람 교체. | ||
| 스파이크(spike) 피크 또는 분산(split) 피크가 시료의 원인에 의해 발생 | 2 개 이상의 시료가 있어서 그 중 시료가 약간 분리가 덜 될 경우. | 두 시료의 완전한 분리를 위한 조건을 찾는다. | |
| 이동상과 시료 녹인 용매가 분리 조건에 있어서 다른 특성을 같을 때. | 이동상으로 시료를 녹인다. 만약 시료가 녹지않으면 먼저 잘 녹는 용매로 녹인 후 이동상으로 다시 녹인다. | ||
| 시료 주입량을 1/2-1/10사이로 줄임. | |||
| 해리성 시료와 비 해리성 이온 시료를 섞는다. | 이동상의 pH를 pka± 2에 조정한다. 또는 더 많은 이온 시료를 가한다. | ||
| 모든 시료가 스파이크 피크 또는 분산 피크가 발생할 때 | 이동상과 시료 녹인 용매가 분리 조건에 있어서 다른 특성을 같을 때. | 이동상으로 시료를 녹인다. 만약 시료가 녹지않으면 먼저 잘 녹는 용매로 녹인 후 이동상으로 다시 녹인다. | |
| 시료 주입량을 1/2-1/10사이로 줄임. | |||
| 칼람이 손상되었을 때. | 칼람 교체. | ||
T2. 고스트 피크(Ghost peaks)
| 분리 모드 | 원인 | 해답 | |
|---|---|---|---|
| <역상 크로마토그라피> 구배(gradient)분리 방법을 이용 |
물 이동상에 불순물 피크 | HPLC 급 증류된 물 사용. | |
| 프리 칼람(pre-column)사용. 198 페이지를 참조하십시오. | |||
| < 역상 크로마토그라피> 단백질 시료 |
전에 분석 시 흡착된 시료 다음 분석 시 용출. | 칼람을 세척하십시오. 세척 방법에 대한 더 자세한 방법은 170 페이지를 참조하십시오. | |
| 단백질 분리에 회수율이 높은 COSMOSIL Protein-R 칼람을 추천합니다. 42 페이지를 참조하십시오. | |||
| <모든 분리 모드> 시료 용매와 이동상이 상당히차이가 남 |
시료 용매가 피크를 유발함. | 이동상과 같은 용매로 시료를 녹인다. | |
| 이동상으로 시료를 녹인다. 만약 시료가 녹지않으면 먼저 잘 녹는 용매로 녹인 후 이동상으로 다시 녹인다. | |||
| <모든 분리 모드> 블 랭 크 분 석(blank analysis) 시 피크가 나옴. (시료 주입 시 피크 면적이 감소) |
인젝터가 오염. | 이동상 20ml 용매를 이용하여 주사기로 인젝터를 세척. 예: 메탄올은 오염물질을 녹일 수 있습니다. |
|
| 마이크로 실린지 오염. | 이동상용 메탄올, 클로로포름 또는 물을 이용하여 오염물질을 세척. 초음파 세척도 효과적입니다. | ||
| 기타 | 오염 또는 시료의 물성 악화 | 시료를 다시 제조. | |
| 안정제 있는 용매 사용 | 안정제 없는 HPLC급 용매사용. | ||